全国统一邮箱为:youclunwen@163.com
全国统一咨询电话为:0757-63959708 ;15899573055
注册地址为:注册地址为:广东省佛山市禅城区同济西路12号永丰大厦A座1211号
2.本网站承诺确保稿件质量,真诚为您服务,杜绝质量差的文章,为客户创造更高的价值。与您携手,创造更美好的明天。
核心论文设计-海洋低温酶酶解珍珠贝的动力学研究
发布日期:2022-10-15 11:15:00
摘 要
本文以珍珠贝为原料,海洋低温酶为催化剂,采用pH-stat法,系统分析了底物浓度、酶浓度、pH及温度对水解度的影响,并运用实验研究结合数学推导的方法,求出海洋低温酶催化水解珍珠贝肉蛋白的动力学模型及海洋低温酶的失活常数。结果表明:海洋低温酶酶解珍珠贝的最佳酶解工艺条件为:酶解温度30℃,时间180min,pH为10.0,初始底物浓度10%,酶浓度2.5g/L。海洋低温酶对珍珠贝肉蛋白进行控制水解的动力学模型分别为:水解速率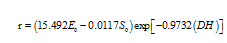 ,水解度
,水解度 ,其酶失活常数
,其酶失活常数 。与实验结果相比较,实验拟合总平均相对误差为3.04%,证实动力学模型与实验结果非常吻合,可用来指导和优化酶解反应实验,具有很好的实际应用价值。
。与实验结果相比较,实验拟合总平均相对误差为3.04%,证实动力学模型与实验结果非常吻合,可用来指导和优化酶解反应实验,具有很好的实际应用价值。
关键词:海洋低温酶;珍珠贝;动力学模型;最佳条件;酶解;水解度
Abstract
The Kinetic Model for Marine Alkaline Protease Digestion of pearl oyster
LIU Qing-qin
In this article,we used pearl oyster as raw material,and used marine alkaline protease as catalyst,
used the pHstat method in order to analyse the effects of substrate concentration, enzyme concentration,pH
and temperature on the hydrolysis degree systematically.
We also used the combined method of experimental analysis and mathematic deduction in order to
obtain the kinetic model equation of marine alkaline protease digestion of pearloyster and
inactivation constant of marine alkaline protease.The result suggested that the optimum hydrolysis process of
marine alkaline protease to hydrolyze pearl oyster was: hydrolysis temperature at 30℃,time at
180min,pH on 10.0, concentration of substrate at 10%,enzymatic concentration at 2.5g/L.
The hydrolysis dynamics model controlled by Marine Alkaline Protease of muscle proteins
from pearl oyster expressed as 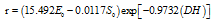 ,
, , the losing active constant of enzyme is
, the losing active constant of enzyme is  .Compared theoretical value with actual value,the average of the total relative error is 3.04%,the dynamic
.Compared theoretical value with actual value,the average of the total relative error is 3.04%,the dynamic
model was proved very good agreement with experimental result,and showed its good practical value.
Key words: marine alkaline protease;pearl oyster;pearl oyster;hydrolysis
目 录
1.前言……………………………………………………………………………1
2.实验材料与方法…………………………………………………………………………2
2.1材料 ………………………………………………………………………………………………2
2.1.1原料……………………………………………………………………………………………2
2.1.2主要试剂………………………………………………………………………………………2
2.1.3主要仪器………………………………………………………………………………………3
2.2方法 ………………………………………………………………………………………………3
2.2.1珍珠贝酶解工艺流程…………………………………………………………………………3
2.2.2游离氨基酸的测定……………………………………………………………………………3
2.2.3珍珠贝总氮含量的测定………………………………………………………………………4
2.2.4水解度的计算方法……………………………………………………………………………5
3.结果与分析……………………………………………………………………………5
3.1海洋低温酶酶解珍珠贝工艺条件优化………………………………………………………… 5
3.1.1pH对酶解反应的影响…………………………………………………………………………5
3.1.2酶解温度对酶解反应的影响…………………………………………………………………5
3.1.3底物浓度对酶解反应的影响…………………………………………………………………6
3.1.4酶浓度对酶解反应的影响……………………………………………………………………7
3.1.5酶解时间对酶解反应的影响…………………………………………………………………7
3.1.6海洋低温酶酶解反应机理探讨…………………………………………………………8
3.2海洋低温酶控制水解的动力学模型推导 ………………………………………………………9
3.3海洋低温酶控制水解的动力学模型推导………………………………………………………11
3.4海洋低温酶控制水解的动力学模型推导………………………………………………………12
3.5海洋低温酶控制水解的动力学模型推导………………………………………………………13
4.结论…………………………………………………………………………………………………14
参考文献…………………………………………………………………………………15
致 谢……………………………………………………………………………………………………16
海洋低温酶酶解珍珠贝的动力学研究
姓名:刘清钦 学号:2007274108 班级:材料化学1班
1.前言
珍珠贝隶属于软体动物门(Mollusca)、瓣鳃纲(Lamellibranchia)、珍珠贝目(Pterioida)、珍珠贝科(Pteriidate),属暖水性动物[1]。我国的珍珠贝主要包括珠母贝属的大珠母贝、珠母贝、黑珠母贝、白珠母贝、马氏珠母贝、长耳珠母贝和珍珠贝属的企鹅珍珠贝等[2]。本文选用的研究对象为马氏珠母贝。
马氏珠母贝又称合浦珠母贝,贝壳斜四方形,背缘略平直,腹缘弧形,前、后缘弓形,壳内面珍珠层较厚,坚硬有光泽,属软体动物门双壳纲珍珠贝目珍珠贝科,在中国主要分布在广西、广东和台湾海峡南部沿海一带。它是我国海水珍珠养殖面积最广,数量最大的贝类,具有较高经济价值,所产珍珠占全世界海水珍珠的90%以上,**的“南珠”即为马氏珠母贝所产。珍珠贝肉营养丰富,含有较多的蛋白质,蛋白质氨基酸高,为优质蛋白,呈味氨基酸比例较高,味道鲜美,无机质含量丰富,锌、硒等微量元素含量较高[3]。珍珠的保健功能已为人们证实[4-5],作为育成珍珠的母体一珠母贝全脏器(珍珠贝肉)就必然含有同等的功效。除此之外,它还具有抗肿瘤、抗疲劳、抗衰老等生理作用[6-8]。目前,我国马氏珍珠贝肉年产量近15万吨,大部分用于鲜食制成干制品或加工成饲料,加工附加值较低,其潜在价值未得到充分利用。它是大宗低值蛋白资源之一,利用酶解技术处理马氏珍珠贝肉是提高其资源利用率和附加值的有效途径。因此,研究其酶解反应机理及特点为酶技术应用于生产具高附加值的马氏珍珠贝肉深加工制品(如活性肽和呈味基料等)提供理论和方法的指导。
本文选用的酶是从海洋生物中提取出来的海洋低温碱性蛋白酶894。海洋低温碱性蛋白酶是一种应用我国海洋嗜极微生物黄海黄杆菌代谢产物并通过现代生物工程手段开发出的一类新型酶。它具有较低的最适反应温度, 在低温范围内具有很高的活性,与底物结合能力及催化活性很强。宋永相,孙谧等[9],研究了海洋碱性蛋白酶894在活性胶原肽制备中的优势性,得出了海洋碱性蛋白酶海洋碱性蛋白酶894、胃蛋白酶、胰蛋白酶降解法制取活性胶原肽。经比较产物的活性、感官性状,发现酶法所得胶原肽明显好于其他方法,而海洋碱性蛋白酶894 降解所需时间最短,活性最高,感官性状最好,成本低,在海洋功能食品原料的制备过程中体现出明显的优势。目前关于海洋低温酶的研究还处于探索阶段,关于其用于酶解贝类的动力学研究尚未有相关报道。
蛋白质的可控酶解是通过对水解条件、水解度以及水解产物的分子量分布等研究,确定出水解条件、水解度与水解产物分子量分布之间的相互关系,从而实现通过控制水解条件、水解度的方法而获得目标分子量分布的水解产物。基于水解底物所含的肽键的种类以及蛋白酶对不同肽键的水解作用的强弱也是不一样,导致蛋白质的可控酶解过程的动力学研究变得比较复杂。因此,对于酶解过程,从反应机理出发,推导出描述蛋白可控酶解过程规律的动力学关系式,建立符合实验数据的实验模型,对于加深对影响蛋白质水解过程因素的理解及指导实践是有实际意义的[10]。
近年来,国内外已开展了相关的蛋白质酶解的动力学研究,主要集中在以大豆蛋白为主的植物蛋白以及以乳蛋白和血红蛋白为主的动物蛋白[11]。例如,Marquez等人[12]研究了以血红蛋白为底物的碱性蛋白酶催化水解的动力学模型;Tello等人[13]以乳清蛋白为底物,研究了MPK Protease 660 L、Al-calase 0.6 L和PEM 2500S等三种酶促水解的动力学模型。本文以珍珠贝肉蛋白为底物,研究海洋低温酶酶解珍珠贝的水解速度与其影响因素之间的内在规律,推导出描述蛋白质酶法水解的动力学模型,为珍珠贝肉蛋白活性肽的规模化生产提供理论依据和技术支持。
2.实验材料与方法
2.1 材料
2.1.1 原料
珍珠贝肉,购于广州黄沙水产品批发市场,由中国科学院南海海洋研究所孙恢礼研究员鉴定。
2.1.2 主要试剂
材料名称 规格 来源
海洋低温碱性蛋白酶894 10万u/g 黄海水产所
盐酸 分析纯 广州化学试剂厂
氢氧化钠 分析纯 广州化学试剂厂
硼酸 分析纯 开原化学试剂厂南方华玻公司
甲基红 分析纯 上海崇明县裕西试剂厂
溴甲酚绿 分析纯 上海试剂三厂
硫酸铜 分析纯 广东汕头转宁化工厂
硫酸钾 分析纯 天津市津沽工商实业有限公司
浓硫酸 分析纯 广州市东红化工厂
甲醛 分析纯 广州光华化学厂有限公司
2.1.3 主要仪器
设备名称 生产厂家
KDN-102C型定氮仪 上海纤检仪器有限公司
BP252AG型多功能食物搅拌器 广东美的生活电器制备有限公司
pHS-3C型精密pH计 雷磁上海精密科学仪器有限公司
800B型台式离心机 上海安亭科学仪器厂
FA2004N型电子分析天平 上海精密科学仪器有限公司
SYC-15超级恒温水浴 南京桑力电子设备厂
78-1型磁力加热搅拌器 杭州电机仪器厂
JJ-1增力电动搅拌器 金坛市宏华仪器厂
2.2 方法
2.2.1 珍珠贝酶解工艺流程
原料珍珠贝→预处理→加水匀浆→调节pH值→保温酶解→测定酶解过程的水解度。
将珍珠贝置于800W的微波炉中,微波加热3min,开壳取蛤肉作为实验原料。加入一定比例的水匀浆1min×3次,等分成20.00g/份,置于-80℃冷冻备用。取20.00g/份的冷冻贝肉糜,解冻,加入一定比例蒸馏水,匀浆1min×3次,匀浆液转入酶解瓶中,以6mol/L的NaOH溶液调节匀浆液pH值,于恒温水浴锅中加热(或冰水浴中制冷)至预设定的酶解温度,待贝肉浆的温度达到预设值时,加入定量的酶,置于确定温度的恒温水浴锅内计时进行酶解,整个酶解过程需要不停搅拌以保证反应充分。酶解结束后,水解液立即置于沸水浴100℃中10min加热灭酶,冷却至室温,在转速4800r/min下离心15min,所得清液即为波纹巴非蛤酶解液。
2.2.2 酶解液游离氨基酸的测定
采用电位滴定法测定游离氨基酸的含量。
吸取5.0ml珍珠贝肉水解液于100ml容量瓶中,加水至标线,混匀后吸取20.0ml 置于200ml 烧杯中,加水60ml,开动磁力搅拌器,用0.05mol/LNaOH标准溶液滴定至pH为8.2,记录消耗NaOH标准溶液体积,以计算总酸含量。加入10.0ml甲醛溶液,混匀。再用上述NaOH标准溶液继续滴定至pH为9.2,记录消耗NaOH标准溶液体积。同时取80ml蒸馏水置于另一只200ml烧杯中,用NaOH标准溶液调至pH为8.2(此时不计碱消耗量),再加入10.0ml中性甲醛溶液,用0.05mol/LNaOH标准溶液滴定至pH为9.2,作为试剂空白试验。
计算方法:
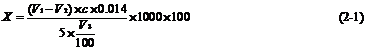
式中: :样品中游离氨基酸含量(mg/100ml);
:样品中游离氨基酸含量(mg/100ml);
 :测定用样品加入甲醛稀释后消耗NaOH标准溶液体积(ml);
:测定用样品加入甲醛稀释后消耗NaOH标准溶液体积(ml);
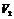 :试剂空白试验加入甲醛后消耗NaOH标准溶液体积(ml);
:试剂空白试验加入甲醛后消耗NaOH标准溶液体积(ml);
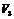 :样品稀释液取用量(ml);
:样品稀释液取用量(ml);
 :NaOH标准溶液的浓度(mol/L);
:NaOH标准溶液的浓度(mol/L);
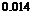 :氮的毫摩尔质量(g/mmol)。
:氮的毫摩尔质量(g/mmol)。
2.2.3 珍珠贝总氮含量的测定
采用标准方法(GB5009.5-85)半微量凯氏定氮法[14]。
取贝肉(真空干燥后)0.5g置于消化管中,加入混合催化剂8g(硫酸铜0.5g,硫酸钾7.5g),混合均匀后再加入20ml浓硫酸,把装有试样的消化管放在消化炉支架上,盖上毒气罩,开始样品消化。保持消化管中液体沸腾,沸酸在瓶颈部下冷凝回流。待消解至无微小颗粒,呈蓝绿色澄清溶液时继续消解30-40min。
将消化后的溶液冷却后,于消化管内逐个加入10ml左右蒸馏水稀释样品。取10ml2%硼酸溶液置于250ml锥形瓶中做接收液,加入3滴甲基红—溴甲酚绿混合指示剂,使凯氏蒸馏装置的冷凝管末端浸入此溶液。消化完全并冷却后的消化管套入防溅管密封圈上保持接口密封。开碱开关,加入适量NaOH溶液至蒸馏液变黑呈碱性颜色为止,关碱开关,开始蒸馏5min。
吸收液用标定后的盐酸溶液进行滴定,以溶液由蓝绿色变为灰紫色为终点。
计算方法:

式中: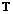 :总氮含量;
:总氮含量;
 :滴定试样时消耗HCl标准溶液的体积(ml);
:滴定试样时消耗HCl标准溶液的体积(ml);
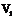 :滴定空白时消耗HCl标准溶液的体积(ml);
:滴定空白时消耗HCl标准溶液的体积(ml);
 :试样分解液总体积(ml);
:试样分解液总体积(ml);
 :试样分解液蒸馏用体积(ml);
:试样分解液蒸馏用体积(ml);
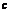 :HCl标准溶液的摩尔浓度(mol/L);
:HCl标准溶液的摩尔浓度(mol/L);
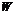 :试样重量(g);
:试样重量(g);
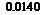 :与1.0ml盐酸标准溶液相当的氮的质量(g);
:与1.0ml盐酸标准溶液相当的氮的质量(g);
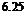 :氮换算为蛋白质的系数。
:氮换算为蛋白质的系数。
2.2.4 水解度的计算方法
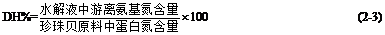
3.结果与分析
3.1 海洋低温酶酶解珍珠贝工艺条件优化
3.1.1 初始pH对酶解反应的影响
在底物浓度为10%,酶浓度为2.50g/L,酶解温度为30℃的条件下,研究起始pH对珍珠贝酶解过程的影响,实验结果如图3-1所示。
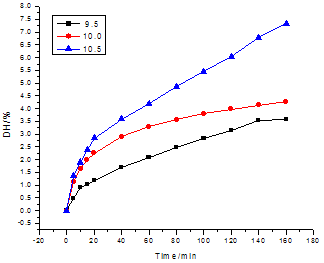
图3-1 pH对水解度的影响
Fig.3-1 Effects of pH on the degree of hydrolysis
由图3-1可知,初始pH值在9.5~10.0之间时,水解度随着pH的增大依次增大。但当pH为10.5时,水解度急剧增加,高达7.33%,这是由于在强碱性条件下,碱对珍珠贝肉蛋白产生水解反应所致。考虑到强碱条件下产生大量盐等不利因素,选择初始pH=10.0为最佳pH。
3.1.2 酶解温度对酶解反应的影响
在底物浓度为10%,酶浓度为2.50g/L,初始pH值为10.0的条件下,研究酶解温度对珍珠贝酶解过程的影响,实验结果如图3-2所示。
图3-2 温度对水解度的影响
Fig.3-2 Effects of temperature on the degree of hydrolysis
由图3-2可知,在相同时间内,随着温度的上升,酶解反应的水解度依次增大。在25~30℃时,水解度增加较快,相比30℃时的水解度,35℃时的水解度增大得并不明显,原因可能是在该反应温度下,海洋低温酶热稳定性较差,作用一段时间之后,部分酶蛋白变性失去活力所致。从低碳环保方面考虑,选择30℃为最佳酶解温度。
3.1.3 底物浓度对酶解反应的影响
在酶浓度为2.50g/L,酶解温度为30℃,初始pH值为10.0的条件下,研究底物浓度对珍珠贝酶解过程的影响,实验结果如图3-3所示。

图3-3 底物浓度对水解度的影响
Fig.3-3 Effects of substrate concentration temperature on the degree of hydrolysis
由图3-3可知,水解度随底物浓度的增加而减小;底物浓度越大,酶反应的初速度越小,水解度越小。其原因一方面可能是由于底物浓度增加,使得过多的底物分子堆集于酶的活化中心,影响酶催化速度及产物分子的扩散,另一方面可能是由于底物浓度增加,使得溶液的粘度增大,影响到酶的扩散和传质,阻碍酶解反应的进行所致。这一现象表明底物具有促进反应速度和对酶产生抑制的双重作用。当底物浓度为8%和10%时,水解度曲线相近,即体系中酶与底物的结合存在一个饱和状态,在酶保持不变的情况下,底物的增加无益于体系水解程度的加深。考虑到水解度相同时,底物浓度高的产出高,因此选择10%为最佳底物浓度。
3.1.4 酶浓度对酶解反应的影响
在底物浓度为10%,酶解温度为30℃,初始pH值为10.0的条件下,研究酶浓度对珍珠贝酶解过程的影响,实验结果如图3-4所示。

图3-4 酶浓度对水解度的影响
Fig.3-4 Effects of enzyme concentration temperature on the degree of hydrolysis
由图3-4可知,对不同初始酶浓度,酶解反应的水解度和水解速率均随初始酶浓度的增大而增强。当酶浓度从1.25g/L增加到2.50g/L时,水解度上升迅速,而酶浓度从3.75g/L到6.25g/L时,水解度上升缓慢。对于同一初始酶浓度,水解速率随时间的延长而下降,其原因一方面可能是经过一段时间的酶解,体系中的易被水解的肽键数目减少,另一方面可能是水解产物中存在对酶有抑制作用的成分。考虑到酶浓度的增加会导致成本的增加,且在较高酶浓度条件下,产物的水解度不易控制,因此选择2.50g/L为最佳酶浓度。
3.1.5 酶解时间对酶解反应的影响
由图3-3、3-4可知,海洋低温碱性蛋白酶的水解随着水解时间
以上内容由论文代写网-优创网整理发布,详情请浏览http://www.youclunwen.com






